Для успешного внедрения в производство системы маркировки лекарственных препаратов необходимо грамотно распределить все имеющиеся ресурсы, создать рабочую группу и составить поэтапный план работ. Процесс реализации проекта по маркировке достаточно трудоемкий и требует должного внимания на каждом уровне. Ниже представлена «дорожная карта» по разработке плана работы по внедрению системы маркировки лекарственных препаратов на производстве.
Шаг 1
Регистрация и внесение необходимых сведений в информационной системе Мониторинг движения лекарственных препаратов (ИС МДЛП)
1.1. Оформить квалифицированную усиленную электронную подпись на руководителя организации.
Сертификат усиленной квалифицированной электронной подписи можно получить в одном из аккредитованных Минкомсвязью России удостоверяющих центров (https://digital.gov.ru/ru/activity/govservices/certification_authority/). Если у вас уже есть усиленная квалифицированная электронная подпись, то вы можете использовать ее.
— Для юридического лица УКЭП должна содержать сведения о ИНН, ОГРН, наименовании и адресе организации, ФИО руководителя организации, в соответствии со справочником ЕГРЮЛ;
— Для индивидуальных предпринимателей УКЭП должна содержать ИНН, ФИО ИП в точном соответствии со справочником ЕГРИП;
— Для представительств иностранных организаций УКЭП должна содержать сведения о ИНН, наименовании и адресе организации, ФИО руководителя организации, в соответствии со справочником РАФП.
1.2. Установить программное обеспечение, необходимое для работы с квалифицированной усиленной электронной подписью.
Программное обеспечение (СКЗИ, драйверы токенов) и инструкции (https://xn--80ajghhoc2aj1c8b.xn--p1ai/upload/Obschaia_instrukciia.pdf) по установке и настройке предоставляет удостоверяющий центр, выдавший сертификат усиленной квалифицированной электронной подписи.
Адрес для регистрации https://mdlp.crpt.ru/#/auth/signin?eyJlcnJvciI6MX0=
При регистрации в ИС МДЛП субъект обращения должен выбрать тип участника (резидент/нерезидент) и заполнить форму регистрации, соответствующую типу участника. Инструкции для регистрации в ИС МДЛП:
— Резиденты РФ вносят в регистрационную форму системы мониторинга в электронном виде следующие сведения:
o идентификационный номер налогоплательщика;
o сведения о наличии либо об отсутствии лицензии на производство лекарственных средств, лицензии на фармацевтическую деятельность (включая оптовую и розничную торговлю лекарственными средствами), лицензии на медицинскую деятельность и лицензии на деятельность по обороту наркотических средств, психотропных веществ и их прекурсоров, культивированию наркосодержащих растений;
o фамилия, имя, отчество (при наличии);
o телефон контактного лица;
o адрес электронной почты.
Организации, признаваемые налоговыми резидентами Российской Федерации, индивидуальные предприниматели и представительства субъектов обращения лекарственных средств на территории Российской Федерации, подписывают заявку усиленной квалифицированной электронной подписью, оформленной на руководителя организации. Соответствующие сведения в форме регистрации заполняются автоматически средствами системы мониторинга на основании данных квалифицированного сертификата. Резиденты РФ, индивидуальные предприниматели, не имеющие лицензии на производство лекарственных средств, лицензии на фармацевтическую деятельность (включая оптовую и розничную торговлю лекарственными средствами), лицензии на медицинскую деятельность и лицензии на деятельность по обороту наркотических средств, психотропных веществ и их прекурсоров, культивированию наркосодержащих растений, а также представительства субъектов обращения лекарственных средств на территории Российской Федерации, не имеющие лицензии на производство лекарственных средств, лицензии на фармацевтическую деятельность (включая оптовую и розничную торговлю лекарственными средствами), лицензии на медицинскую деятельность и лицензии на деятельность по обороту наркотических средств, психотропных веществ и их прекурсоров, культивированию наркосодержащих растений, не позднее 10 календарных дней с даты внесения сведений в электронной форме предоставляют также в Росздравнадзор по адресу: 109074, Москва, Славянская площадь, д. 4, строение 1 — заявление о регистрации в системе мониторинга на бумажном носителе по форме (см. Форма заявления о регистрации в Федеральной государственной информационной системе мониторинга движения лекарственных препаратов для медицинского применения организаций, признаваемых налоговыми резидентами Российской Федерации, не имеющих лицензии на производство лекарственных средств, лицензии на фармацевтическую деятельность, лицензии на деятельность по обороту наркотических средств, психотропных веществ и их прекурсоров, культивированию наркосодержащих растений и лицензии на медицинскую деятельность, а также представительств иностранных организаций на территории Российской Федерации, являющихся держателями или владельцами регистрационных удостоверений лекарственных препаратов – РЕКОМЕНДАЦИИ для участников Эксперимента по маркировке средствами идентификации и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения от 02.10.2019)
— иностранный резидент вносит в регистрационную форму системы мониторинга в электронном виде следующие сведения:
o наименование держателя или владельца регистрационного удостоверения;
o код налогоплательщика в стране регистрации (аналог идентификационного номера налогоплательщика);
o страна регистрации;
o почтовый индекс;
Уполномоченные представители субъектов обращения лекарственных средств – иностранных организаций, являющихся держателями или владельцами регистрационного удостоверения, не признаваемых налоговыми резидентами Российской Федерации и не имеющих представительств на территории Российской Федерации, не позднее 10 календарных дней с даты внесения сведений в электронной форме, предоставляют также в Росздравнадзор по адресу: 109074, Москва, Славянская площадь, д. 4, строение 1 оригиналы документов, подтверждающих право представления интересов указанных субъектов обращения лекарственных средств, и заявление на бумажном носителе по форме (см. Форма заявления о регистрации в Федеральной государственной информационной системе мониторинга движения лекарственных препаратов для медицинского применения иностранных организаций, являющихся держателями или владельцами регистрационных удостоверений лекарственных препаратов, не признаваемых налоговыми резидентами Российской Федерации и не имеющих представительств на территории Российской Федерации, через уполномоченных представителей — РЕКОМЕНДАЦИИ для участников Эксперимента по маркировке средствами идентификации и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения от 02.10.2019)
Обработка и проверка сведений, предоставляемых в систему мониторинга для регистрации, производится в автоматическом режиме в течение 14 рабочих дней с даты подачи субъектами обращения лекарственных средств сведений в систему мониторинга.
Росздравнадзор рассматривает заявления и оригиналы документовв срок не более 5 рабочих дней и передает информацию о результатах рассмотрения заявлений и оригиналов документов в систему мониторинга в течение 1 рабочего дня со дня принятия соответствующего решения.
1.4. Регистрация в ГС 1 РУС GTIN.
При описании лекарственных препаратов внесение сведений в ГС 1 РУС и систему мониторинга осуществляется следующими субъектами обращения лекарственных средств:
— в случае производства лекарственных препаратов в Российской Федерации – производители лекарственных средств, осуществляющие фасовку (упаковку) лекарственных препаратов во вторичную (потребительскую) упаковку лекарственного препарата (а при ее отсутствии – в первичную упаковку лекарственного препарата);
— в случае производства лекарственных препаратов вне территории Российской Федерации – держатели или владельцы регистрационного удостоверения и (или) представительства субъектов обращения лекарственных средств на территории Российской Федерации.
Субъекты обращения лекарственных средств лекарственные препараты в системе мониторинга на основании электронной заявки, содержащей:
o глобальный идентификационный номер торговой единицы;
o номер регистрационного удостоверения и дату регистрации лекарственного препарата в государственном реестре лекарственных средств.
1.5. Внесение необходимых сведений в личном кабинете ИС МДЛП (местах осуществления деятельности, о производимых ЛП, о доверенных контрагентах).
Субъект обращения лекарственных средств, получивший уведомление о регистрации в системе мониторинга, при активации функций личного кабинета вносит в систему мониторинга перечень адресов мест осуществления деятельности путем выбора такого адреса из адресов, указанных в лицензиях на производство лекарственных средств, лицензиях на фармацевтическую деятельность (включая оптовую и розничную торговлю лекарственными средствами), лицензиях на медицинскую деятельность и лицензии на деятельность по обороту наркотических средств, психотропных веществ и их прекурсоров, культивированию наркосодержащих растений, а также перечень адресов фармацевтических складов (при наличии указанных лицензий).
Субъект обращения лекарственных средств – держатель или владелец регистрационного удостоверения произведенного вне территории Российской Федерации лекарственного препарата и (или) представительство субъекта обращения лекарственных средств на территории Российской Федерации, получивший уведомление о регистрации в системе мониторинга, вносит в систему мониторинга информацию о производственных площадках, осуществляющих фасовку (упаковку) лекарственных препаратов во вторичную (потребительскую) упаковку лекарственного препарата (а при ее отсутствии – в первичную упаковку лекарственного препарата) и производственную стадию выпускающего контроля качества.
1.6. Подать заявку на участие в эксперименте.
Заявка на участие в Эксперименте на добровольной основе оформляется в системе мониторинга в электронном виде.
Требования для производителей:
— маркировка вторичных упаковок лекарственных препаратов – DataMatrix код, качество нанесения кода не ниже класса С;
— состав кода (согласно ПП РФ №1118 структура информации, содержащейся в средстве идентификации):
o признак символики GS1 DataMatrix символ, имеющий код 232 в таблице символов ASCII;
o первая группа данных – глобальный идентификационный номер торговой единицы (14 символов), идентификатор применения (01);
o вторая группа данных – индивидуальный серийный номер торговой единицы (13 символов), идентификатор применения (21). Завершающим символом для этой группы данных является специальный символ-разделитель, имеющий код 29 в таблице символов ASCII;
o третья группа данных – идентификатор ключа проверки, предоставляемый эмитентам средств идентификации оператором системы мониторинга в составе кода проверки, которому предшествует идентификатор применения (91), и состоящий из 4 символов (цифр, строчных и прописных букв латинского алфавита, а также специальных символов). Завершающим символом для этой группы данных является специальный символ-разделитель, имеющий код 29 в таблице символов ASCII;
o четвертая группа данных — значение кода проверки, предоставляемое эмитентам средств идентификации оператором системы мониторинга в составе кода проверки, которому предшествует идентификатор применения (92), и состоящее из 44 символов (цифр, строчных и прописных букв латинского алфавита, а также специальных символов).
Запрос третьей и четвертой групп данных производится с использованием РЭ и СУЗ
— читаемая информация
o согласно 61 ФЗ на упаковку ЛП должны наноситься в виде читаемого печатного текста: дата истечения срока годности, номер серии;
o согласно Постановлению Правительства РФ №1556 в виде читаемого печатного текста на упаковку ЛП должны наноситься: глобальный идентификационный номер торговой единицы; индивидуальный серийный номер торговой единицы
Таким образом, на упаковке ЛП должны быть нанесены в читаемом виде:
o глобальный идентификационный номер торговой единицы (GTIN);
o индивидуальный серийный номер торговой единицы;
o дата истечения срока годности;
o номер серии
2.1. Провести анализ технологического процесса фасовки и упаковки лекарственных препаратов с учетом требований по сериализации и агрегации.
— Определение места нанесения кода маркировки DataMatrix и необходимости внесения изменений в макет вторичной упаковки по причине нехватки свободного места для кода маркировки DataMatrix или необходимости изменения цветового (полиграфического) решения вторичной упаковки из-за риска плохой считываемости.
— Подготовка новых макетов упаковочных материалов и внесение изменений в регистрационное досье на ЛП (при необходимости).
— Определить потребность в оборудовании по сериализации, учитывая способ упаковки лекарственных препаратов (ручной/автоматический) и производительность упаковочной линии.
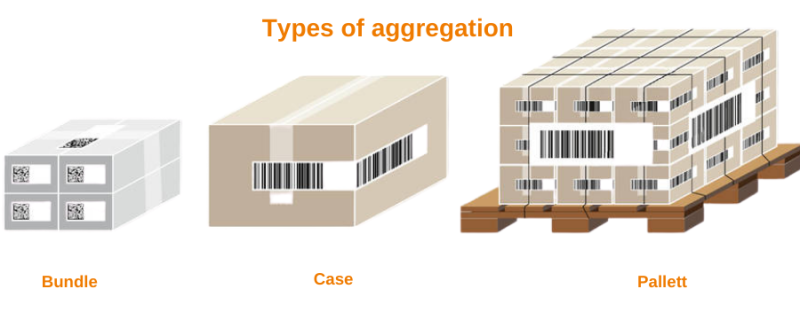
— Выбрать необходимую степень агрегации (бандероль, гофрокороб, паллета) и способ агрегации (ручной/автоматический).
— Определить способ укладки готовой продукции в третичную упаковку (ручной/автоматический).
— Изучить способ подачи с учетом размера упаковки (дополнительные конвейера и переворотные приспособления).
2.2. Составить техническое задание и направить производителям оборудования по сериализации, агрегации, провести конкурс поставщиков, заключить договор на поставку оборудования.
2.3. Поставка оборудования. Провести ПНР. Валидация оборудования. Ввод в эксплуатацию.
3.1. Провести анализ существующей ИТ-структуры компании на предмет совместимости с ПО уровня L3. Выбрать ПО уровня L3-L4.
— Проверить наличие вычислительных мощностей для ПО уровня L3 и процедур резервного копирования данных.
— Разработать систему безопасности для базы данных данных серийных номеров, либо дополнить существующую систему безопасности с учетом нового репозитория уникальных серийных номеров.
— Провести анализ необходимости интеграции существующих ERP систем с ПО уровня L3.
— Осуществить выбор ИТ-оборудования и ПО уровня L3-L4, соответствующих информационной системе и задачам предприятия.
3.2. Обеспечить взаимодействие с СУЗ и регистратором эмиссии, представляемым ООО «Оператор — ЦРПТ».
— Интеграция через API СУЗ ИТ-инфраструктуры предприятия, отвечающей за маркировку, с регистратором эмиссии, предоставляемым ООО «Оператор-ЦРПТ», для получения кодов маркировки и обмена пакетами данных, в том числе, тестирование взаимодействия с API СУЗ информационной системы МДЛП для отладки процессов запроса кодов маркировки DataMatrix; подключение к тестовому регистратору эмиссии для проведения комплексного нагрузочного тестирования программного обеспечения и оборудования сериализации;
получение доступа к регистратору эмиссии для выпуска пилотной партии ЛП с нанесенным на упаковку кодом маркировки DataMatrix.
Для проверки информационного обмена СУЗ-МДЛП необходимо подать заявку на демо контур тестовый СУЗ- МДЛП (песочница).
Подать заявку на регистратор эмиссии путем направления официального письма в ЦРПТ или в личном кабинете ФГИС МДЛП.
Производитель может установить регистратор непосредственно на производстве или в ЦОДе оператора маркировки с предоставлением удаленного доступа (рекомендуется).
РЭ выдается на каждое место осуществления деятельности, указанное в лицензии на производство лекарств.
НЕОБХОДИМО: Заключить договор на безвозмездное пользование РЭ, лицензионное соглашение на СУЗ, договор на услугу по предоставлению кодов маркировки с ЦРПТ.
Заполнить анкету на получение регистраторов эмиссии можно в личном кабинете в разделе «Профиль», в подразделе «Анкеты и договоры». После заполнения и отправки электронной анкеты заявители получают сформированный пакет документов от ЦРПТ для заключения договора на предоставление регистратора и его обслуживание. Поставка оборудования осуществляется в соответствии с условиями договора, обычно в течение 30 календарных дней после подписания документов. Устройство регистратора эмиссии и услуги по его обслуживанию предоставляются оператором маркировки бесплатно. Регистраторами эмиссии в первую очередь оснащаются производители лекарств по госпрограмме ВЗН. Устройства рекомендуется размещать в центре обмена данных (ЦОД) ЦРПТ, поскольку это ускоряет процесс установки и гарантирует бесперебойную работоспособность. Кроме того, ЦРПТ оказывает техническую поддержку. При размещении в ЦОД ЦРПТ компании-производителю предоставляется удаленный доступ.
3.3. Провести комплексное тестирование технологических процессов сериализации и агрегации, процессов информационного обмена с ИС МДЛП.
— Протестировать процесс запроса кодов маркировки посредством СУЗ и регистратора эмиссии;
— Протестировать процесс нанесения кодов маркировки на вторичную упаковку ЛП;
— Провести тестирование регистрации отчетов в ИС МДЛП
Таким образом, в результате всех шагов:
— Компания выполняет операции по сериализации вторичной упаковки ЛП и операции агрегирования:
o Оборудование по сериализации установлено;
o Регистратор эмиссии заказан и получен
o Станция управления заказами интегрирована с ПО уровня L3
— Компания регистрирует операции движения лекарственных препаратов в ИС МДЛП:
o Компания зарегистрировано в ИС МДЛП;
o Внесены данные о лекарственных препаратах, местах осуществления деятельности, доверенных контрагентах;
o Отчеты регистрируются с ИС МДЛП.
Следующий логический шаг после сериализации
Фармацевтическая агрегация по своему определению связывает медицинские изделия с уникальным серийным номером (лекарства) с более высокими уровнями упаковки с уникальным серийным номером. Серийные изделия поступают в более крупную тару (коробку, связку или паллету). В пачке бутылок или картонных коробок каждая единица имеет свой серийный номер, но сама пачка имеет верхнюю этикетку с уникальным серийным номером. Короче говоря, фармацевтическая агрегация — это процесс создания иерархических отношений между уникальными идентификаторами, присвоенными упаковочным контейнерам.
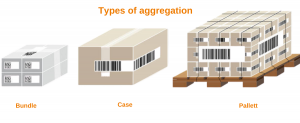
Агрегация в фармацевтике — это следующий логический шаг в требованиях к отслеживанию и отслеживанию, и многие компании, которые начали (или завершили) процесс внедрения сериализации в фармацевтике, предвидят этот следующий важный шаг.
Запрашивать информацию
Процесс агрегации в фармацевтической промышленности призван облегчить и принести пользу всем, кто участвует в цепочке поставок, от производителей лекарств до конечных потребителей.
Во-первых, агрегация фарм значительно облегчает использование переделок. Это возможно потому, что вся необходимая и в то же время важная информация о лекарствах будет доступна при сканировании большего кода упаковки. Это сэкономит много времени, поскольку нам больше не нужно будет открывать каждый контейнер для сканирования каждого отдельного пакета. Отгрузочные поддоны могут быть выведены из эксплуатации оптом в случае повреждения всего поддона или его части при транспортировке. Фармацевтическая агрегация значительно упростит регистрацию поврежденных продуктов из системы.
Оптимизация деятельности цепочки поставок, основанная на агрегировании, может упростить отчетность и проверку продукта на одной или нескольких остановках в цепочке поставок. При сканировании штрих-кода все необходимые данные можно получить за считанные секунды, что приводит к значительной экономии времени и ресурсов.
Вся информация в одном месте
Фармацевтическая агрегация предоставляет всю необходимую информацию и упрощает отслеживание любых лекарств по всей цепочке поставок, что делает систему более эффективной, безопасной и заслуживающей доверия.
Проактивные фармацевтические компании находят значительную экономию средств за счет внедрения технологий отслеживания и агрегирования. Большая часть этой экономии достигается за счет повышения эффективности процессов и цепочки поставок. Многие компании теперь рассматривают эту технологию как серьезное конкурентное преимущество в современной глобальной экономике, когда они достаточно гибки, чтобы соответствовать требованиям Track & Trace многих стран.
Эффективный отзыв или возврат продукта
Технология агрегации упрощает управление всем процессом возврата товарно-материальных ценностей. Это также помогает производителям фармацевтической продукции осуществлять целевые отзывы конкретных единиц продукта вместо большого количества ненужного количества.
Откройте для себя решение для агрегации от SoftGroup

Полуавтоматическая агрегация с камерой Top view
Промышленный эксперт считает это следующим логическим шагом после сериализации, особенно когда сериализация одной упаковки определяется как проверенная защита от подделки и целостность лекарств.
Закон США о безопасности цепочки поставок лекарственных средств (DSCSA) с самого начала существенно изменил силу лекарств. Он был создан с целью удаления до 60%, поддельных лекарств, но DSCSA служит дополнительной цели. Он обеспечивает соответствие пробелов для каждого фармацевтического продукта и устанавливает пошаговые инструкции, которым должны следовать фармацевтические компании в цепочке поставок.
Как фармацевтическая промышленность, $ 1 триллион мировых производителей в Индии и Китае упаковывают упаковку в Южной Европе, контрафактная продукция важна для фармацевтических поставщиков в любой точке США, Азии и во всем мире. Более важно защитить целостность на второстепенных уровнях, поскольку у вас есть много возможностей для продажи товаров.
«Идентификатор упаковки»
Переход на один шаг от сериализации, процесс подключения объектов с разными номерами к макету более высокого уровня, а также уникальный серийный номер. Их называют «родителями». Например, каждая единица гидроксихлорохина имеет свой идентификатор, и каждая партия имеет этикетку с уникальным серийным номером. В данном случае тара детская и коробчатая.
Как работает агрегатор?
Общие преимущества
Использование некоторых из крупнейших фармацевтических сетей связано со значительными преимуществами, предоставляемыми интеграцией в систему отслеживания продуктов. Вот некоторые из них:

Гибкость в региональных требованиях: агрегирование облегчает внедрение комплексных и импортируемых по сети лекарств. Ожидается, что многие страны, в том числе Соединенные Штаты, примут агрегацию фармацевтических препаратов в рамках своих нормативных требований по отслеживанию и отслеживанию.
Агрегация может сэкономить много времени, потому что вам обычно не нужно открывать коллекции или дела для сканирования отдельных «детей». Имея доступ ко всем вашим данным, вы можете легко отслеживать свои продукты в каждой транзакции, и вся ваша система распределения работает эффективно, безопасно и надежно.
Обязательна ли агрегация?
Давайте посмотрим правде в глаза! DSCSA США и FMD (Директива о контрафактных лекарствах) Европейского Союза не собирают и не используют агрегированные данные. Тем не менее, это рекомендуется, потому что это повышает целостность закупок, а также вышеуказанные причины и преимущества.


